שעון קנדה 2022-01-24, RhoVac, חברת תרופות המתמקדת באימונולוגיה של גידולים, הודיעה כי בקשת הפטנט שלה (מס' 2710061) על חיסון הפפטיד הסרטני שלה RV001 תאושר על ידי משרד הקניין הרוחני הקנדי (CIPO).בעבר, החברה השיגה פטנטים הקשורים ל-RV001 בארצות הברית, אירופה ויפן.הענקת פטנט זו תספק הגנה רחבה יותר ל-RV001 בשווקי מפתח ותעלה את חסמי הפטנטים של החברה.
כמו בקשת הפטנט שניתנה בעבר, פטנט זה מכסה את החיסון לסרטן RV001 והגרסאות שלו, כמו גם את השימוש בו בטיפול/מניעה של סרטן גרורתי המביע RhoC.ביניהם, RhoC הוא אנטיגן הקשור לגידול (TAA) המתבטא יתר על המידה בסוגי תאי גידול שונים.לאחר הענקתו, הפטנט יפוג בשנים 2028-12 וצפוי להאריך עם קבלת תעודת הגנה משלימה (CSP).
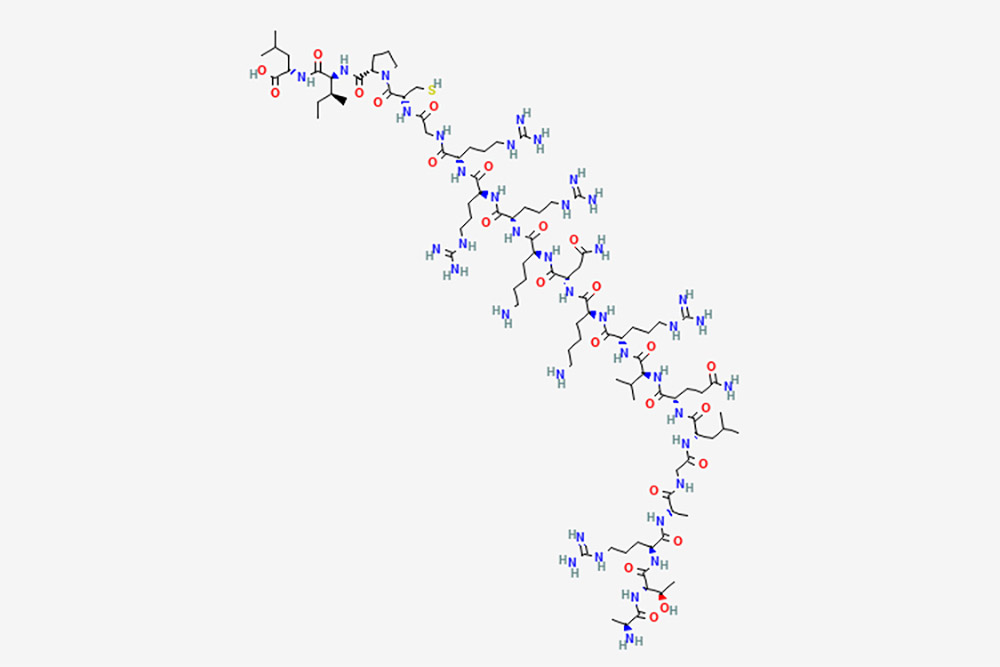
01 אונילקמוטיד
Onilcamotide הוא חיסון לסרטן המורכב מפפטידים אימונוגניים שמקורם ב-Ras הומולוגי בן משפחה C (RhoC), אשר ניתנים לאמולסציה בתוסף החיסוני montanide ISA-51, עם פוטנציאל לפעילות אימונומודולטורית ואנטי-גידולית.מתן תת עורי של Onilcamotide ממריץ את מערכת החיסון המארחת לעורר תגובה הומורלית וציטוטוקסית לימפוציטים T (CTL) לתאי גידול המבטאים RhoC, ובכך מפיצה את תאי הגידול.
2020-11, RV001 זכה בסימן Fast Track על ידי ה-FDA.
02 ניסויים קליניים
בשנת 2018 אושר הניסוי הקליני Phase I/IIa של Onilcamotide לטיפול בסרטן הערמונית, ובסך הכל נרשמו 21 חולים.התוצאות הראו כי Onilcamotide בטוח ונסבל היטב.בנוסף, המטופלים פיתחו תגובות חיסוניות חזקות ועמידות בעקבות הטיפול.בשנת 2021, מעקב של 19 מהנבדקים הללו, שלוש שנים לאחר סיום הטיפול על ידי RhoVac, הראה כי נבדקים אלו לא פיתחו גרורות כלשהן או קיבלו טיפול נוסף ואין להם התקדמות משמעותית של אנטיגן ספציפי לערמונית (PSA)..מתוכם, ל-16 נבדקים לא היה PSA ניתן לזיהוי, ול-3 נבדקים הייתה התקדמות PSA איטית.PSA הוא חלבון המיוצר על ידי בלוטת הערמונית ומשמש למעקב אחר התקדמות סרטן הערמונית ידוע.
בשנת 2019, ה-RV001 Phase IIb BraVac הקליני (אקראי, כפול סמיות, מבוקר פלצבו) הופעל כדי להעריך את יעילותו במניעה או הגבלת התפתחות של סרטן ערמונית גרורתי לאחר ניתוח/הקרנות.ניסוי קליני IIb זה הוא מחקר בינלאומי רב-מרכזי המגייס נבדקים ב-6 מדינות אירופיות (דנמרק, פינלנד, שוודיה, בלגיה, גרמניה ובריטניה) וארצות הברית.הניסוי השלים את גיוס המטופלים בשנים 2021-09, עם סך של כ-175 נבדקים נרשמו, ויסתיים ב-2022H1.בנוסף, RhoVac מתכננת לערוך מחקרי חקירה פרה-קליניים שמטרתם לספק ראיות אינדיקטיביות להתרחבות של RV001 באינדיקציות.
בנוסף, הוועדה לניטור הבטיחות ערכה גם סקירת בטיחות ביניים של RV001 בשנים 2021-07, ולא נמצאו תופעות לוואי בלתי צפויות, מה שעולה בקנה אחד עם התוצאות הקליניות הקודמות בשלב I/II.
זמן פרסום: 17-2-2022